什么是蛋白激酶A?
蛋白激酶A也被称为环腺苷酸依存性蛋白激酶(PKA),其是一种结构最简单、生化特性最明确的蛋白激酶。
蛋白激酶的作用
蛋白激酶简称PK,已经发现的有400多种,是催化蛋白质磷酸化过程的酶,根据其活化条件的不同,可分为蛋白激酶A、蛋白激酶G、蛋白激酶C和钙调蛋白的蛋白激酶。蛋白激酶的作用是:
1、通过磷酸化调节蛋白质活性,即磷酸化后有活性;
2、通过蛋白质的逐级磷酸化,使信号逐级放大,从而引起细胞反应。
什么是蛋白质磷酸化?
是指三磷酸腺苷未位的磷酸转移到基质蛋白质的特定氨基上,所进行的共价修饰的一类反应总和。
蛋白激酶A由什么组成?
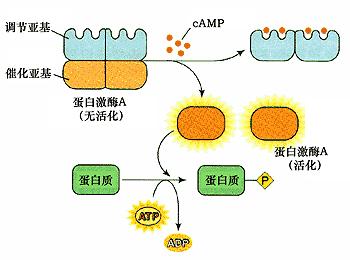
蛋白激酶A由两个催化亚基和两个调节亚基组成,在没有cAMP时,是以钝化复合体形式存在。cAMP与调节亚基结合,改变调节亚基构象,使调节亚基和催化亚基解离,释放出催化亚基。活化的蛋白激酶A催化亚基可使细胞内某些蛋白的丝氨酸或苏氨酸残基磷酸化,于是改变这些蛋白的活性,进一步影响到相关基因的表达。
蛋白激酶A的作用是什么?其激活机制是什么?
蛋白激酶A也称为CAMP依赖性蛋白激酶,通过CAMP而被激活(CAMP激活蛋白激酶A机制:传递信号的第一信使主要有儿茶酚胺类激素、胰高血糖素、腺垂体的激素、下丘脑激素等。其受体属于G蛋白偶联型膜受体,G蛋白有激活型的Gs和抑制型的Gi两种。腺苷酸环化酶(AC)存在于细胞膜上,可接受G蛋白的激活,催化ATP转化为CAMP,导致细胞内CAMP升高,从而激活蛋白激酶A)。
PKA被激活后具有催化作用,其释放的催化亚基,可以催化ATP末端磷酸基团转移到蛋白底物的丝氨酸或苏氨酸残基上。这种磷酸化过程通常导致底物活性的变化。由于PKA存在于多种细胞中,作用于不同的底物,PKA调节和cAMP调节涉及许多不同的通路。
PKA被激活后具有催化作用,其释放的催化亚基,可以催化ATP末端磷酸基团转移到蛋白底物的丝氨酸或苏氨酸残基上。这种磷酸化过程通常导致底物活性的变化。由于PKA存在于多种细胞中,作用于不同的底物,PKA调节和cAMP调节涉及许多不同的通路。
蛋白激酶A进一步作用的机制,可分为直接蛋白质磷酸化和蛋白质合成。在蛋白质直接磷酸化过程中,PKA直接增加或降低蛋白质的活性。在蛋白质合成中,PKA首先直接激活CREB,CREB结合cAMP反应元件,从而改变转录,改变蛋白质的合成。一般来说,这种机制需要更长的时间(几小时到几天)。
蛋白激酶A和蛋白激酶c的共同之处是什么?
蛋白激酶C是G蛋白偶联受体系统中的效应物, 在非活性状态下是水溶性的,游离于胞质溶胶中,激活后成为膜结合的酶。蛋白激酶A和蛋白激酶c途径的共同特点是由G蛋白介导。


